Хантераза (Hunteraza)
1-Z А Б В Г Д Е - Ж - З И - Й К Л М Н О П Р С Т У Ф Х Ц Ч - Щ Э Ю - Я
Клинико-фармакологическая форма - идурсульфаза
Форма выпуска
Концентрат для приготовления раствора для инфузий 2 мг/мл.
Описание препарата Хантераза (Hunteraza)
Прозрачный или слегка опалесцирующий бесцветный раствор.Состав
Состав на 1 флакон:
Действующее вещество: идурсульфаза бета - 6,00 мг
Вспомогательные вещества:
натрия дигидрофосфата моногидрат - 6,75 мг
натрия фосфата двухосновного гептагидрат - 2,97 мг
натрия хлорид - 24,00 мг
полисорбат 20 - 0,66 мг
вода для инъекций - до 3 мл.
Показания к применению
Хантераза показана для длительного лечения больных с синдромом Хантера (мукополисахаридоз II типа, МПС II).
Противопоказания к применению
Клинически выраженная или представляющая угрозу для жизни пациентов повышенная чувствительность к действующему веществу или любому из вспомогательных веществ в тех случаях, когда симптомы не устраняются при проведении соответствующего лечения.
Беременность,
Применение у больных с нарушениями функции печени и почек
Опыт клинического применения препарата у больных с нарушениями функции печени и почек отсутствует.
Применение у пожилых больных
Опыт применения препарата у пациентов старше 35 лет отсутствует.
Применение у детей
У детей до 38 месяцев нет опыта применения препарата.
Возможные побочные эффекты
ВНИМАНИЕ! Если вы подозреваете, что при приеме препарата ваше самочувствие ухудшилось, появились какие-то побочные эффекты, нужно сразу же обратиться очно к врачу, назначившему препарат!
Нежелательные реакции, отмеченные в ходе клинических исследований препарата Хантераза, почти во всех случаях были легкими или умеренными по степени тяжести.
Наиболее частыми реакциями, связанными с введением препарата, были кожные реакции (крапивница, высыпания и зуд). Все нежелательные реакции
были незначительными и сведены к минимуму путем регулирования скорости инфузии и применения соответствующей лекарственной терапии. Возможные нежелательные реакции, возникшие на фоне приема препарата, представленные ниже, перечислены по системам органов в соответствии с частотой встречаемости: очень часто (?1/10), часто (?1/100-< 1/10).
Инфекционные и паразитарные заболевания:
очень часто - инфекции верхних дыхательных путей, бронхит, синусит, отит
среднего уха, фаринготонзилит;
часто - инфекция глаз (ячмень), пневмония*.
Нарушения со стороны колеи и подкожных тканей:
очень часто - крапивница, кожный зуд, дерматит, грибковые поражения туловища,
часто - эритематозная сыпь, атопический дерматит, экзема, пятна, грибковые поражения стопы.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
очень часто - кашель, ринорея, аллергический ринит;
часто - ринит, бронхиальная астма, эпистаксис, продуктивный кашель*, остановка дыхательных движений во время сна.
Нарушения со стороны желудочно-кишечного тракта:
очень часто - диарея, гастроэнтерит, энтерит;
часто - тошнота, рвота, запор, трещина заднего прохода, поражение аноректальной области, диспепсия, стоматит, заболевание зубов.
Общие расстройства и нарушения в месте введения препарата:
очень часто - лихорадка;
часто - ухудшение общего состояния.
Нарушения со стороны скелетно-мышечной и соединительной ткани:
часто - мышечные спазмы, миалгия.
Нарушения со стороны органа зрения:
часто - конъюнктивит, сухой кератоконъюнктивит*.
Травмы, интоксикации и осложнения манипуляций:
часто - припухлость в области инфузии.
Нарушения со стороны половых органов и молочных желез:
часто - баланопостит*.
Нежелательные реакции, зарегистрированные в клинических исследованиях в группе 1,0 мг/кг препарата Хантераза
Нельзя исключать возможность возникновения анафилактических реакций (см. раздел "Особые указания").
У пациентов с полным отсутствием (делецией) или значительным изменением последовательности генов (реаранжировкой) риск развития реакций, связанных с инфузионным введением препарата, повышен (см. раздел "Особые указания").
Иммуногенность
У всех пациентов после введения препарата Хантераза в ходе клинических исследований не было обнаружено антител в течение периода наблюдения.
У детей
Нежелательные реакции, наблюдаемые у детей, по характеру и частоте встречаемости не отличались от соответствующих реакций у взрослых пациентов.
Дозировка, как принимать Хантераза (Hunteraza)
Препарат предназначен для внутривенного инфузионного введения (см. подраздел "Приготовление раствора для инфузий").
Введение препарата Хантераза необходимо проводить под контролем врача или другого медицинского работника, который имеет опыт лечения больных с мукополисахаридозом II типа или другими наследственными нарушениями метаболизма.
Препарат Хантераза следует вводить внутривенно в течение периода от 1 до 3 часов в дозе 0,5 мг/кг массы тела один раз в неделю. Пациентам может потребоваться удлинение времени инфузии в связи с нежелательными реакциями на фоне инфузии, однако продолжительность инфузии не должна превышать 8 часов. Первоначальная скорость инфузии должна составлять 8 мл/ч в течение первых 15 минут. Если инфузия переносится пациентом удовлетворительно, то можно увеличить скорость введения препарата на 8 мл/ч через каждые 15 минут доведя до 40 мл/час - до конца введения препарата. Скорость инфузии не должна превышать 100 мл/ч. Если возникают нежелательные реакции на фоне инфузии, то, в соответствии с клиническими проявлениями, скорость инфузии можно уменьшить и/или временно приостановить или прекратить. Препарат Хантераза не следует вводить одновременно с другими препаратами через общий катетер для инфузий.
Дети
Детям и подросткам следует вводить препарат в дозе 0,5 мг/кг массы тела один раз в неделю.
Приготовление раствора для инфузий
Препарат Хантераза представляет собой концентрат для приготовления раствора для инфузий во флаконе, содержащий 2 мг/мл идурсульфазы бета. Флаконы препарата Хантераза не содержат антимикробных консервантов и предназначены только для одноразового использования.
Перед внутривенным введением содержимое флакона необходимо развести
0,9 % раствором натрия хлорида для инъекций с соблюдением правил асептики следующим образом:
1. Определить количество флаконов препарата Хантераза необходимое пациенту на 1 введение, которое необходимо развести с учетом массы тела пациента и рекомендуемой дозы (0,5 мг/кг массы тела).
Вес пациента (кг) х 0,5 мг/кг идурсульфазы бета + 2 мг/мл = Общее количество (мл) препарата Хантераза.
Общее количество (мл) препарата Хантераза ч- 3 мл/фл = Общее количество флаконов препарата Хантераза.
Полученное общее количество флаконов препарата Хантераза необходимо округлить до целого значения.
2. Провести визуальный осмотр каждого флакона, чтобы убедится, что раствор является бесцветным прозрачным или слегка опалесцирующим, без видимых частиц.
3. Извлечь рассчитанный объем препарата Хантераза из соответствующего количества флаконов и развести в 100 мл 0,9 % раствора натрия хлорида для инъекций с соблюдением правил асептики. Рекомендуется использование системы для инфузий, оборудованной фильтром с диаметром пор 0,2 микрометра. После разведения раствора для инфузий систему для инфузий или контейнер необходимо осторожно перемешать, не встряхивая.
4. С точки зрения микробиологической безопасности, после разведения готовый к применению раствор для инфузий следует использовать незамедлительно. В случае невозможности незамедлительного использования, ответственность за время и условия хранения возлагается на потребителя, и в таком случае допускается хранение разведенного раствора для инфузий в холодильнике при температуре от 2 до 8 °С не более 48 часов, в случае хранения разведенного раствора при комнатной температуре он должны быть использован в течение 8 часов.
Влияние на беременность
Беременность
Данные о применении препарата Хантераза у беременных женщин отсутствуют. В рамках проведенных доклинических исследований репродуктивной функции у животных не отмечено изменений в таких показателях как: до - и постимплантационные потери. В качестве меры предосторожности, предпочтительно избегать применения препарата Хантераза при беременности.
Период грудного вскармливания
Нет данных о применении препарата Хантераза в период грудного вскармливания.
Неизвестно, выделяется ли идурсульфаза бета с грудным молоком. Невозможно исключить риск для детей, получающих грудное вскармливание, поэтому решение о продолжении приема препарата Хантераза должно приниматься с учетом пользы грудного вскармливания для ребенка и пользы терапии препаратом Хантераза для кормящей.
Фертильность
Действие препарата Хантераза на фертильность человека не изучено. Исследования идурсульфазы бета на животных не выявили негативного воздействия не фертильность.
Управление транспортом
Не влияет на способность управлять транспортными средствами и выполнять работу, требующую повышенной концентрации внимания и быстроты психомоторных реакций.
Дополнительные указания при приеме Хантераза
Реакции, связанные с инфузионным введением препарата
У пациентов, получавших идурсульфазу бета, могут развиться реакции, связанные с инфузионным введением препарата, такие как расстройство дыхания, гипоксия, гипотония, апоплексический удар и (или) ангионевротический отек. Побочные реакции могут быть купированы путем снижения скорости введения препарата, прекращением инфузий или введением антигистаминных средств, глюкокортикостероидов.
Особые меры предосторожности необходимы при введении Хантеразы пациентам с тяжелым сопутствующим заболеванием дыхательных путей. Может потребоваться госпитализация пациентов в специализированное отделение для проведения инфузионного введения препарата и контроля клинического состояния. У этих пациентов следует ограничивать или тщательно контролировать использование антигистаминных препаратов или других седативных средств. В некоторых случаях может потребоваться поддержание положительного давления в дыхательных путях.
Следует отложить введение препарата Хантераза, если у пациента развилось острое респираторное заболевание с повышением температуры. Для больных, использующих заместительную кислородотерапию, необходимо иметь запас кислорода во время введения препарата на случай развития нежелательной реакции.
Анафилактические реакции
У некоторых пациентов возможно возникновение жизнеугрожающих анафилактических реакций. Отсроченные признаки анафилактических реакций могут наблюдаться и спустя 24 часа после первоначальной реакции. При развитии анафилактической реакции инфузию следует немедленно прекратить, начать соответствующее лечение и наблюдение. Следует придерживаться текущих стандартов неотложной терапии. Пациентам с тяжелыми или рефрактерными анафилактическими реакциями может потребоваться длительное клиническое наблюдение. Пациентам, у которых в прошлом отмечались анафилактические реакции на введение препарата Хантераза, назначать препарат повторно следует с осторожностью, в период введения препарата необходимо присутствие специально обученного медицинского персонала и наличия оборудования для проведения реанимационных мероприятий. Тяжелые и опасные для жизни реакции гиперчувствительности в случаях, когда состояние пациентов не поддается контролю, является противопоказанием для повторного применения препарата (см. раздел "Противопоказания").
Особенности действия препарата при первом приеме
Особенностей действия препарата при первом приеме не наблюдалось.
Разведенный раствор для инфузий
Каждый флакон препарата Хантераза предназначен только для однократного применения.
Оставшийся разведенный раствор для инфузий после использования следует утилизировать.
Препарат следует назначать с осторожностью пациентам с тяжелыми сопутствующими заболеваниями дыхательных путей.
Передозировка
Нет опыта передозировки препарата Хантераза у человека.
Как хранить препарат
При температуре от 2 до 8 °С в защищенном от света месте. Не замораживать!
Хранить в недоступном для детей месте!
Срок годности
2 года.
Не применять препарат по истечении срока годности.
Условия отпуска
По рецептуИнформация по упаковке
По 3,0 мл препарата во флаконах объемом 6,0 мл из бесцветного стекла типа I, укупоренных пробками из бутил каучука с тефлоновым покрытием, и завальцованных алюминиевыми колпачками с пластиковой отламывающейся крышечкой фиолетового цвета.
По
Информация для врачей о препарате Хантераза
Фармакологическая группа
Препараты для лечения заболеваний пищеварительного тракта и нарушений обмена веществ - ферментыФармакодинамика
Мукополисахаридоз II типа (МПС II) или Синдром Хантера представляет собой редкое Х-сцепленное рецессивное наследственное заболевание, вызванное дефицитом в организме пациента лизосомального фермента идуронат-2-сульфатазы. Идуронат-2-сульфаза участвует в первом этапе катаболизма гликозаминогликанов (ГАГ) - гепаран- и дерматансульфата. В результате недостаточной активности идуронат-2-сульфатазы возникает накопление гликозаминогликанов (ГАГ) - гепаран- и дерматансульфата в лизосомах практически всех типов клеток различных тканей и органов, что приводит к клеточному перенасыщению, органомегалии, разрушению тканей и нарушению функции органов.
Идурсульфаза бета представляет собой очищенную форму лизосомального фермента идуронат-2-сульфатазы - рекомбинантная человеческая идуронат- 2-сульфатаза (рчИДС). рчИДС продуцируется по технологии рекомбинантной ДНК с использованием линии клеток яичника китайского хомячка (СНО) (клетка - хозяин: СНО DG44 / вектор экспрессии: ID pJK dhfr Оr2).
Идурсульфаза бета - это гликопротеин с 525 аминокислотами с молекулярной массой около 78 КДа, который содержит восемь участков аспарагин-связанного гликозилирования, занятых комплексными олигосахаридными структурами и двумя дисульфидными связями. Ферментативная активность Идурсульфазы бета зависит от посттрансляционной модификации специфичного цистеина в формилглицин. Внутривенное введение пациентам с синдромом Хантера идурсульфазы бета обеспечивает поступление экзогенного фермента в клеточные лизосомы. Маннозо-6-фосфатные остатки (М6Ф) на олигосахаридных цепях позволяют ферменту специфически связываться с М6Ф-рецепторами на клеточной поверхности, что приводит к интернализации фермента, нацеленного на внутриклеточные лизосомы, и последующему катаболизму накапливающихся ГАГ.
Эффективность и безопасность Хантеразы была подтверждена в ходе двух клинических исследований у пациентов мужского пола с синдром Хантера в возрасте от 38 месяцев до 35 лет в течение 24 - 52 недель.
Эффективность лечения оценивалась на основании процентного изменения от исходного уровня ГАГ в моче пациентов, дистанции, проходимой больными за 6 минут, показателей форсированной жизненной емкости легких, объема печени, размера и функции сердца, подвижности суставов, роста и развития пациентов.
Фармакодинамических эффект Хантеразы на накопление ГАГ оценивали в исследованиях на животных. Применение Хантеразы привело к достоверному сокращению уровня ГАГ в моче и тканях животных, тем самым демонстрируя терапевтическую эффективность препарата.Фармакокинетика
Информация о фармакокинетических параметрах Хантеразы была получена в ходе клинического исследования пациентов с синдромом Хантера.
По результатам анализа кривая зависимости сывороточной концентрации Идурсульфазы бета от времени показала кривую кажущегося двухфазного выведения. Кажущийся конечный период полувыведения (t1/2, z) составил 7,3-9,1 часов. В группе пациентов, получивших Хантеразу в дозе 0,5 мг/кг Сmах составила 1024,9 нг/мл, a AUClast - 2724 нгч/мл, В группе пациентов, получивших Хантеразу в дозе 1,0 мг/кг, Сmах составила 2045,2 нг/мл, a AUClast - 7804 нгч/мл.
В пределах диапазона дозы 0,5-1,0 мг/кг Сmах и AUClast показали тенденцию к увеличению экспозиции, в то время как кажущийся конечный период полувыведения (t1/2, z) не показал значительных различий.
Деградация гликопротеинов происходит путем белкового гидролиза с образованием небольших пептидных остатков и аминокислот, поэтому нарушения функции почек или печени не влияют на фармакокинетические параметры идурсульфазы бета.
Мутации в гене IDS, ответственные за возникновение синдрома Хантера, происходят вне зависимости от расы и географического региона, поэтому из- за характера и редкости заболевания такие внутренние факторы как пол, раса, рост, масса тела, возраст не могут оказать существенного влияния на фармакокинетические параметры идурсульфазы бета. Внешние факторы (например, лекарственные взаимодействия, диета, курение или употребление алкоголя) также признаны не влияющими на экспозицию белковых препаратов, вводимых внутривенно.
По результатам доклинических исследований безопасности на животных при оценке токсичности после однократного и повторного внутривенного введения Хантеразы, репродуктивной токсичности, воздействия на мужскую фертильность не установлено специфического риска для человека Исследования на животных не выявили связанных с применением Хантеразы воздействий на сердечно-сосудистую систему, дыхательные параметры, центральную нервную систему и гистопатологических изменений в головном мозге и нервной систем.
Взаимодействие с другими веществами
Исследования взаимодействия препарата Хантераза с другими лекарственными препаратами не проводились.

Секреты долголетия: уроки из синих зон Земли

Влияние микропластика на здоровье: что говорят эксперты

Новый подход к менопаузе: заморозка ткани яичника может изменить все

Омега-3 vs. витамин D: что выбрать для здоровья иммунной системы?

Сможем ли мы добавить больше активной жизни к нашим годам?

Новое исследование: как фантазии помогают укрепить память
 Противопоказания для массажа
Противопоказания для массажа Мануальная терапия при болях в стопе (в суставе Лисфранка)
Мануальная терапия при болях в стопе (в суставе Лисфранка)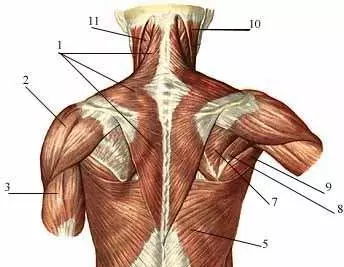 Анатомия мышц спины, поверхностные мышцы спины
Анатомия мышц спины, поверхностные мышцы спины Массаж для беременных
Массаж для беременных

