Флюарикс (Fluarix)
1-Z А Б В Г Д Е - Ж - З И - Й К Л М Н О П Р С Т У Ф Х Ц Ч - Щ Э Ю - Я
Клинико-фармакологическая форма - вакцина для профилактики гриппа [инактивированная]
Форма выпуска
Суспензия для внутримышечного и подкожного введения.
Описание препарата Флюарикс (Fluarix)
Бесцветная слегка опалесцирующая жидкость.Состав
| Название компонентов | Содержание в 0,5 мл |
| Действующие вещества: | |
| Гемагглютинин вирусных штаммов: - A(H1N1)** - A (H3N2)** . в** | 15 мкг 15 мкг 15 мкг |
| Вспомогательные вещества: | |
| Натрия хлорид | 4,00 мг |
| Натрия гидрофосфата додекагидрат | 1,30 мг |
| Натрия гидрофосфата додекагидрат | 1,30 мг |
| Полисорбат-80 (твин-80)/ Октоксинол-Ю (тритон Х-100) | не более 0,50 мг |
| Калия дигидрофосфат | 0,19 мг |
| Альфа-токоферола > сукцинат | не более 0,10 мг |
| Калия хлорид | 0,10 мг |
| Магния хлорида гексагидрат | 0,05 мг |
| Вода для инъекций | до 0,50 мл |
| ** указываются антигены, входящие в состав вакцины, которые обновляются ежегодно в соответствии с рекомендациями ВОЗ для Северного полушария и решением ЕС по составу гриппозных вакцин текущего эпидемического сезона. |
Вакцина не содержит тиомерсал (мертиолят).
Показания к применению
Профилактика гриппа у детей старше 6 мес и взрослых.
Вакцинация против гриппа показана детям, посещающим дошкольные учреждения; учащимся 1-11 классов; студентам высших профессиональных и средних профессиональных учебных заведений; взрослым работающим по отдельным профессиям и должностям (работникам медицинских и образовательных учреждений, транспорта, коммунальной сферы и др.); взрослым старше 60 лет.
Кроме этих категорий, прививки против гриппа особенно рекомендуются лицам, страдающим заболеваниями сердечно-сосудистой системы, хронической почечной недостаточностью, заболеваниями обмена веществ (сахарный диабет), муковисцидозом, хроническими респираторными заболеваниями, а также лицам с первичным и приобретенным иммунодефицитом.
Вакцинация также показана остальным группам населения.
Прививки следует проводить ежегодно в возрастной дозировке с использованием препарата, имеющего антигенный состав, рекомендованный для данного эпид сезона.
Противопоказания к применению
Повышенная чувствительность к активным или вспомогательным веществам препарата,а также к гентамицина сульфату,формальдегиду, натрия дезоксихолату, яичному и куриному белку, используемым в технологическом процессе.
В 0,5 мл вакцины содержится не более 0,05 мкг овальбумина.
Введение вакцины Флюарикс® должно быть отложено у лиц с острыми инфекционными и неинфекционными заболеваниями, обострением хронических заболеваний. Вакцинация проводится через 2-4 недели после выздоровления или в период реконвалесценции или ремиссии. При нетяжелых ОРВИ, острых кишечных заболеваниях и др. прививки проводятся сразу после нормализации температуры.
Возможные побочные эффекты
ВНИМАНИЕ! Если вы подозреваете, что при приеме препарата ваше самочувствие ухудшилось, появились какие-то побочные эффекты, нужно сразу же обратиться очно к врачу, назначившему препарат!
Данные клинических исследований
В контролируемых клинических исследованиях вакцина Флюарикс® вводилась более чем 22 000 вакцинируемых в возрасте от 18 до 60 лет и более чем 2 000
вакцинируемых в возрасте от 6 мес до 18 лет. Нежелательные явления
регистрировались в течение 7 дней после введения вакцины. Вакцинированных также просили сообщать обо всех нежелательных явлениях в течение 30-дневного периода последующего наблюдения.
Нежелательные реакции, приведенные ниже, перечислены по системам организма и в соответствии с частотой встречаемости.
Частота встречаемости определяется следующим образом: очень часто (> 1/10),
часто (> 1/100 и < 1/10), нечасто (> 1/1 000 и < 1/100), редко (> 1/10 000 и < 1/1 000), очень редко (< 1/10 000, включая отдельные случаи).
Частота встречаемости нежелательных явлений
Со стороны обмена веществ и питания
Очень часто: потеря аппетита..
Со стороны нервной системы
Очень часто: раздражительность,сонливость, головная боль.
Нечасто: головокружение.
Со стороны скелетно-мышечной и соединительной ткани
Очень часто: миалгия.
Часто: артралгия.
Со стороны кожи и подкожно-жировой клетчатки
Часто: повышенное потоотделение.
Общие реакции и реакции в месте введения
Очень часто: боль в месте инъекции,чувство усталости.
Часто: покраснение, припухлость и уплотнение в месте инъекции, тремор. Нечасто: лихорадка.
1 - у вакцинируемых в возрасте от 6 мес до 5 лет.
2 - очень часто у вакцинируемых в возрасте от 6 мес до 18 лет.
3 - часто у вакцинируемых в возрасте от 6 мес до 18 лет.
Данные пострегистрационного наблюдения
Со стороны кроветворной и лимфатической системы
Редко: транзиторная лимфаденопатия.
Со стороны нервной системы
Редко: неврит, острый рассеянный энцефаломиелит, синдром Гийена-Барре.
- спонтанные сообщения о нежелательных явлениях были получены после иммунизации вакциной Флюарикс®, однако причинно-следственной связи между вакцинацией и синдромом Гийена-Барре не обнаружено.
Со стороны иммунной системы
Редко: аллергические реакции (в том числе анафилактические реакции).
Со стороны желудочно-кишечного тракта
Редко: рвота.
Со стороны кожи и подкожно-жировой клетчатки
Редко: зуд, эритема, сыпь, ангионевротический отек, крапивница.
Общие реакции
Редко: гриппоподобный синдром,недомогание.
Дозировка, как принимать Флюарикс (Fluarix)
Флюарикс® вводится внутримышечно или подкожно.
Больным с тромбоцитопенией и другими заболеваниями свертывающей системы крови вакцина должна вводиться подкожно.
Вакцину ни при каких обстоятельствах нельзя вводить внутривенно.
ВНИМАНИЕ! Перед использованием шприц с вакциной необходимо энергично
встряхнуть до образования равномерно опалесцирующей жидкости.
Схемы вакцинации
Прививочная доза составляет:
- дети в возрасте от 36 мес и взрослые: 0,5 мл.
- дети от 6 мес до 35 мес: 0,25 мл.
Детям от 6 мес до 9 лет вакцину вводят однократно или двукратно. Двукратно
вакцину вводят детям ранее не вакцинированным, с интервалом не менее 4
недель.
Детям от 9 лет и взрослым вакцину вводят однократно.
Для иммунизации детей, которым показано введение 0,25 мл вакцины, необходимо ввести половину содержимого шприца до риски. Остаток вакцины в шприце использованию не подлежит.
Влияние на беременность
Беременность
Безопасность применения вакцины Флюарикс® у беременных женщин не изучалась. Исследования, проводимые на животных, не продемонстрировали прямых или косвенных эффектов, опасных в отношении репродуктивных функций или развития токсичности. Тем не менее, при беременности Флюарикс® следует назначать только в случае явной необходимости, когда возможная польза превышает потенциальные риски.
Лактация
Безопасность применения вакцины Флюарикс® у женщин в период лактации не изучалась.
Управление транспортом
Маловероятно влияние на способность управлять автомобилем или механизмами.Дополнительные указания при приеме Флюарикс
Флюарикс® предотвращает заболевания, вызванные вирусом гриппа, и не предотвращает инфекции верхних дыхательных путей, вызванные другими возбудителями.
Как и при парентеральном введении любых других вакцин, наготове должно быть все необходимое для купирования возможной анафилактической реакции на Флюарикс®. Вакцинированный должен находиться под медицинским наблюдением в течение 30 мин после иммунизации, а места проведения прививок должны быть обеспечены средствами противошоковой терапии. ,
После вакцинации или иногда перед ней возможны , обмороки или выраженная слабость как психологическая реакция на инъекцию. Перед вакцинацией важно удостовериться, что пациент не получит повреждений в случае обморока.
Вакцина с измененными физическими свойствами (изменение цвета, наличие посторонних включений), а также в случае, если блистер вскрыт или поврежден, применению не подлежит.
Вакцинацию Флюарикс® проводят ежегодно перед началом эпидемического сезона гриппа или как того требует эпидемическая ситуация.
Передозировка
Данные отсутствуют.
Как хранить препарат
УСЛОВИЯ ХРАНЕНИЯ И ТРАНСПОРТИРОВАНИЯ
Вакцину хранят и транспортируют при температуре от 2 °С до 8 °С. Не замораживать.
Хранить вакцину в недоступном для детей месте.
Срок годности
1 год.
Не применять после истечения срока годности, указанного на упаковке.
Датой окончания срока годности является последний день месяца, указанного на
упаковке.
Условия отпуска
По рецептуИнформация по упаковке
По 0,5 мл в одноразовом стеклянном шприце с иглой в колпачке или без иглы. По 1 шприцу в блистере. По 1 блистеру вместе с инструкцией по применению в картонной пачке.По 5 шприцев в блистере. По 2 блистера вместе с инструкцией по применению в карт
Информация для врачей о препарате Флюарикс
Фармакологическая группа
МИБП - вакцинаФармакодинамика
ИММУНОЛОГИЧЕСКИЕ СВОЙСТВА
Флюарикс® обеспечивает защиту на текущий сезон гриппа. Индуцирует выработку нейтрализующих антител к гемагглютинину вирусов гриппа в защитном титре (> 1:40) у большего числа лиц, чем это определено требованиями Европейской Фармакопеи для вакцин против гриппа (> 70% для взрослых 18-60 лет и > 60% для взрослых 60 лет и старше).
Уровень серопротекции вакцины Флюарикс®, изученный у детей в возрасте от 6 до 71 мес и взрослых, также превышает требования Европейской Фармакопеи. После введения вакцины Флюарикс® наблюдается значительно повышение титра антител в сыворотке.
Взаимодействие с другими веществами
Эффективность иммунизации может быть снижена из-за проводимой одновременно с ней иммуносупрессивной терапией, а также при наличии иммунодефицита. Флюарикс® можно вводить одновременно с вакцинами против других инфекций, указанных в Национальном календаре профилактических прививок (за исключением вакцины БЦЖ) и календаре
профилактических прививок по эпидемическим показаниям, при этом
вакцины вводятся в разные участки тела в отдельных шприцах.
После вакцинации результаты серологических тестов на выявление антител к ВИЧ, гепатиту С, вирусу Т-клеточного лейкоза человека, полученные методом ИФА (иммуноферментного анализа), могут быть ложно-позитивными. Это связано с перекрестной реактивностью Ig М, индуцированных вакциной, и ранних антител к возбудителям инфекций, перечисленных выше.
Для верификации лабораторного анализа необходимо проведение подтверждающих (референс-) тестов, таких, например, как иммуно- или вестерн-блоттинг.

Секреты долголетия: уроки из синих зон Земли

Влияние микропластика на здоровье: что говорят эксперты

Новый подход к менопаузе: заморозка ткани яичника может изменить все

Омега-3 vs. витамин D: что выбрать для здоровья иммунной системы?

Сможем ли мы добавить больше активной жизни к нашим годам?

Новое исследование: как фантазии помогают укрепить память
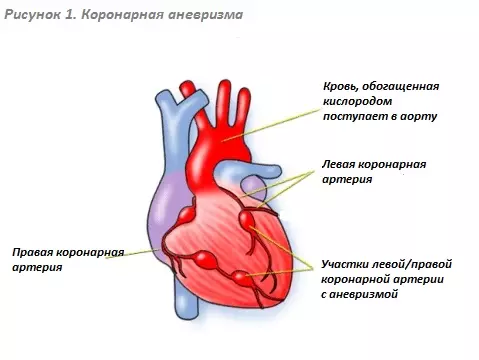 Аневризма коронарной артерии
Аневризма коронарной артерии Тампонада сердца
Тампонада сердца Синдром слабости синусового узла
Синдром слабости синусового узла Электрокардиографическая диагностика локализации критической окклюзии в коронарной артерии
Электрокардиографическая диагностика локализации критической окклюзии в коронарной артерии

