Феморикс® (Femorix)
1-Z А Б В Г Д Е - Ж - З И - Й К Л М Н О П Р С Т У Ф Х Ц Ч - Щ Э Ю - Я
Клинико-фармакологическая форма - терифлуномид
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 14 мг.
Описание препарата Феморикс® (Femorix)
Круглые двояковыпуклые таблетки, покрытые пленочной оболочкой белого или почти белого цвета. На поперечном разрезе ядро таблетки белого или почти белого цвета.Состав
Состав на одну таблетку
Одна таблетка, покрытая пленочной оболочкой, содержит:
Активное вещество: терифлуномид - 14,00 мг;
Вспомогательные вещества: целлюлоза микрокристаллическая - 121,80 мг, карбоксиметилкрахмал натрия - 3,50 мг, магния стеарат - 0,70 мг.
Оболочка: гипромеллоза Е6 - 2,40 мг, титана диоксид - 1,00 мг, тальк - 0,19 мг, макрогол 6000 S - 0,67 мг.
Показания к применению
Лечение взрослых пациентов с рецидивирующе-ремитирующим рассеянным склерозом.Противопоказания к применению
Гиперчувствительность к действующему веществу или какому-либо из вспомогательных веществ.
Тяжелая форма печеночной недостаточности (класс С по шкале Чайлд-Пью).
Беременность. Перед началом терапии терифлуномидом необходимо исключить беременность.
Кормление грудью.
Женщины с сохранным детородным потенциалом, не использующие надежные методы контрацепции, и при плазменной концентрации терифлуномида выше 0,02 мг/л.
Тяжелый иммунодефицит, например, СПИД.
Тяжелое нарушение костномозгового кроветворения, включая клинически значимую анемию, лейкопению, нейтропению или тромбоцитопению.
Тяжелая почечная недостаточность, требующая проведения гемодиализа.
Тяжелые активные инфекции.
Тяжелая гипопротеинемия.
Возраст до 18 лет.
Возможные побочные эффекты
ВНИМАНИЕ! Если вы подозреваете, что при приеме препарата ваше самочувствие ухудшилось, появились какие-то побочные эффекты, нужно сразу же обратиться очно к врачу, назначившему препарат!
Краткое описание профиля безопасности
Суммарно в различных исследованиях терифлуномида принимали участие 2267 пациентов (1155 принимали терифлуномид в дозе 7 мг и 1112 - в дозе 14 мг). Средняя продолжительность применения препарата составила около 672 дней в четырех плацебо- контролируемых исследованиях с участием пациентов с рецидивирующими формами рассеянного склероза (РРС). В плацебо-контролируемых исследованиях приняли участие по 1045 и 1002 пациента в группах 7 и 14 мг терифлуномида соответственно, и по 110 пациентов в каждой группе в одном исследовании с активным препаратом сравнения. Терифлуномид - основной метаболит лефлуномида. Информация о профиле безопасности лефлуномида у пациентов с ревматоидным или псориатическим артритом может быть использована при назначении терифлуномида пациентам с рассеянным склерозом. Объединённые данные плацебо-контролируемых исследований основывались на опыте применения терифлуномида один раз в день 2047 пациентами с рецидивирующими формами рассеянного склероза. Среди этих пациентов наиболее часто сообщаемыми нежелательными реакциями на фоне лечения терифлуномидом были: головная боль, диарея, повышение уровня АЛТ. тошнота и алопеция. В целом, головная боль, диарея, тошнота и алопеция были легкими или умеренными, преходящими и редко приводили к прекращению лечения.
Нежелательные реакции с частотой > 1 %, чем при приеме плацебо, отмеченные при приеме терифлуномида в дозировке 7 и 14 мг в ходе плацебо-контролируемых исследований, приведены ниже. Частоту определяли следующим образом: очень частые (? 1/10); частые (? 1/100, <1/10); нечастые (? 1/1000, <1/100); редкие (? 1/10000, <1/1000); очень редкие (< 1/10000); частота неизвестна (невозможно установить по имеющимся данным).
| Классы и системы органов | Очень часто | Часто | Нечасто | Редко | Очень редко | Неизвестно | ||
| Инфекции | Грипп, инфекции верхних дыхательных путей. Инфекции мочеполовых путей. Бронхит. Синусит. Фарингит. Цистит. Вирусные гастроэнтериты. Оральный герпес. Инфекции зубов. Ларингит. Микоз стоп. | Тяжелые инфекции, включая сепсис | ||||||
| Кровь и заболевания лимфатической системы | Нейтропения, анемия | Тромбоцитопения легкой степени (тромбоциты <100х109/л) | ||||||
| Нарушения со стороны иммунной системы | Смешанные аллергические реакции легкой степени | Реакции гиперчувствительности (немедленные или отсроченные), включая анафилактический шок и отек Квинке | ||||||
| Психические нарушения | Тревога | |||||||
| Нарушения со стороны нервной системы | Головная боль | Парестезия, Пояснично-крестцовый радикулит, Синдром запястного канала | Гиперестезия, Невралгия, Периферическая нейропатия | |||||
| Нарушения со стороны сердца | Сердцебиение | |||||||
| Сосудистые нарушения | Гипертензия | |||||||
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Интерстициальные заболевания легких* | |||||||
| Нарушения со стороны ЖКТ | Диарея, тошнота | Боль в верхних отделах живота, рвота, зубная боль | Панкреатит, стоматит | |||||
| Нарушения со стороны кожи и подкожных тканей | Алопеция | Сыпь, угревая сыпь | Тяжелые кожные реакции | |||||
| Нарушения со стороны опорно-двигательного аппарата и соединительной ткани | Мышечно-скелетные боли, миалгия, артралгия | |||||||
| Нарушения со стороны почек и мочевыводящих путей | Поллакиурия | |||||||
| Нарушения репродуктивной системы, заболевания молочной железы | Меноррагия | |||||||
| Общие нарушения и нарушения в месте введения | Боль | |||||||
| Исследования | Увеличение уровня аланинаминотрансферазы (АЛТ) | Увеличение уровня гамма-глутамилтрансферазы, увеличение уровня аспартатаминотрансферазы, уменьшение веса, уменьшение количества нейтрофилов, уменьшение количества лейкоцитов, увеличение уровня креатинин фосфокиназы в крови | ||||||
| Травмы, отравления и осложнение процедуры | Посттравматическая боль | |||||||
*Только на основании информации о профиле безопасности лефлуномида
Описание отдельных нежелательных реакций
Алопеция
Алопеция была описана как истончение волос, снижение плотности волосяного покрова, потеря волос, связанная или не связанная с изменениями в текстуре волос у 13,9% пациентов, принимавших терифлуномид в дозе 14 мг по сравнению с 5,1% пациентов, принимавших плацебо. Большая часть случаев была описана как диффузное или генерализованное поражение всего скальпа (без полной потери волос). В большинстве случаев данная нежелательная реакция отмечалась в течение первых 6 месяцев, со спонтанным выздоровлением у 121 из 139 (87,1%) пациентов. 1,3% участников прекратили терапию в связи с развитием алопеции в группе терифлуномида по сравнению с 0,1% в группе плацебо.
Нежелательные реакции со стороны печени
В плацебо-контролируемых исследованиях было установлено:
| Увеличение уровня АЛТ (на основании лабораторных данных) в соответствии с исходным статусом - Популяция изучения безопасности в плацебо-контролируемых исследованиях | ||
| Плацебо (N=997) | Терифлуномид 14 мг (N=1002) | |
| >3 ВГН | 66/994 (6,6%) | 80/999 (8,0%) |
| >5 ВГН | 37/994 (3,7%) | 31/999(3,1%) |
| >10 ВГН | 16/994(1,6%) | 9/999 (0,9%) |
| >20 ВГН | 4/994 (0,4%) | 3/999 (0,3%) |
| АЛТ >3 ВГН и общ. билирубин >2 ВГН | 5/994 (0,5%) | 3/999 (0,3%) |
ВГН - верхняя граница нормы
В группах пациентов, получавших терифлуномид, чаще по сравнению с плацебо наблюдалось увеличение активности трансаминазы АЛТ менее или равное 3 ВГН. Процент пациентов, у которых отмечалось повышение АЛТ выше 3-х ВГН, был сопоставим во всех группах. Повышение уровня АЛТ отмечалось в основном в первые шесть месяцев лечения. После прекращения лечения активность фермента АЛТ возвращалась к норме. Время до нормализации активности фермента АЛТ варьировало от нескольких месяцев до нескольких лет.
Влияние на артериальное давление
В плацебо-контролируемых исследованиях было установлено следующее:
Повышение систолического артериального давления выше 140 мм рт. ст. отмечено у 19,9% пациентов, принимавших терифлуномид в дозе 14 мг в день в сравнении с 15,5% на фоне плацебо;
Повышение систолического артериального давления выше 160 мм рт. ст. отмечено у 3,8% пациентов, принимавших терифлуномид в дозе 14 мг в день в сравнении с 2,0% на фоне плацебо;
Повышение диастолического артериального давления выше 90 мм рт. ст. отмечено у 21,4% пациентов, принимавших терифлуномид в дозе 14 мг в день в сравнении с 13,6% на фоне плацебо.
Инфекции
В плацебо-контролируемых исследованиях в группе терифлуномида 14 мг не наблюдалось увеличения количества случаев серьезных инфекций (2,7% в сравнении с 2,2% в группе плацебо). Серьезные оппортунистические инфекции отмечены в 0,2 % случаев в каждой группе.
Наблюдались серьезные инфекционные реакции, включая сепсис. В некоторых случаях был отмечен смертельный исход.
Гематологические эффекты
В плацебо-контролируемых исследованиях на фоне применения терифлуномида наблюдалось умеренное уменьшение количества лейкоцитов (< 15% от исходного уровня, в основном уменьшение количества нейтрофилов и лимфоцитов). В то же время, у некоторых пациентов отмечалось более выраженное уменьшение количества лейкоцитов. Данная нежелательная реакция происходила в ходе первых 6 недель. Затем, на фоне продолжающегося лечения число лейкоцитов стабилизировалось на достигнутом уровне (< 15% уменьшения от исходного уровня). Влияние на количество эритроцитов (< 2%) и тромбоцитов (< 10%) было менее выраженным.
Периферическая нейропатия
В плацебо-контролируемых исследованиях в группах терифлуномида 14 мг наблюдалось увеличение количества случаев периферической нейропатии, включая полинейропатию и мононейропатию (синдром запястного канала), в сравнении с плацебо. В основных плацебо-контролируемых исследованиях периферическая полинейропатия, подтвержденная исследованиями нервной проводимости, была отмечена у 1,9% пациентов (17 из 898) в группе терифлуномида 14 мг в сравнении с 0,4% (4 пациента из 898) в группе плацебо. Лечение было прервано у 5 пациентов с периферической нейропатией, получавших терифлуномид в дозе 14 мг. Выздоровление после прекращения лечения было зафиксировано у 4 из этих пациентов.
Новообразования доброкачественные, злокачественные и неопределенные (включая кисты и полипы)
В клинических исследованиях на фоне приема терифлуномида не зафиксировано повышения риска возникновения злокачественных опухолей. Риск возникновения злокачественных опухолей, а именно лимфопролиферативных заболеваний, увеличивается при применении некоторых других лекарственных средств, влияющих на иммунную систему.
Дозировка, как принимать Феморикс® (Femorix)
Внутрь. Таблетки следует принимать целиком, запивая водой, независимо от приема пищи. Рекомендованная доза составляет 14 мг в день.
Влияние на беременность
Беременность
Данные о применении терифлуномида беременными женщинами ограничены. Исследования на животных продемонстрировали репродуктивную токсичность.
Терифлуномид не рекомендован во время беременности. Беременным женщинам следует рекомендовать воспользоваться процедурой ускоренного выведения для быстрого снижения концентрации терифлуномида в плазме.
Женщинам детородного возраста до начала лечения необходимо оценить возможный серьезный потенциальный риск для плода и использовать эффективные средства контрацепции в период лечения терифлуномидом, а также после прекращения терапии до достижения концентрации препарата в плазме не более 0,02 мг/л (обычно период составляет 8 месяцев). В случае задержки менструации на фоне приема терифлуномида необходимо срочно информировать врача об этом и выполнить тест на беременность. В случае положительного результата врач должен обсудить с пациенткой все риски, связанные с беременностью, проверить остаточную концентрацию терифлуномида. В случае, если концентрация превышает 0,02 мг/л, рекомендуется повторить процедуру ускоренной элиминации.
Женщинам, стремящимся к беременности, следует рекомендовать воспользоваться процедурой ускоренного выведения для быстрого снижения концентрации терифлуномида в плазме. В связи с индивидуальными отклонениями в клиренсе лекарственного препарата может потребоваться контроль концентраций терифлуномида в плазме в течение 2-х лет после прекращения терапии. Процедуру ускоренного выведения можно также использовать в любое время после прекращения терапии терифлуномидом.
Процедура ускоренной элиминации:
- Колестирамин в дозе 8 г 3 раза в день на протяжении 11 дней, или в случае плохой переносимости этой дозы можно использовать дозу 4 г колестирамина 3 раза в день.
- Альтернативно можно принимать по 50 г активированного угля каждые 12 часов на протяжении 11 дней.
Фертильность
Результаты исследований на животных не продемонстрировали какого-либо воздействия на фертильность. Несмотря на отсутствие данных для людей, воздействие на мужскую и женскую фертильность маловероятно.
Грудное вскармливание
Исследования на животных продемонстрировали выделение терифлуномида в грудное молоко. Неизвестно, попадает ли этот лекарственный препарат в грудное молоко у женщин. В связи с тем, что многие лекарственные препараты выделяются в грудное молоко, а также в связи с вероятностью развития серьезных нежелательных реакций, связанных с действием терифлуномида, у грудных детей, следует принять решение о прекращении грудного вскармливания или прекращении приема лекарственного препарата с учетом степени необходимости лекарственного препарата для матери.
Применение у мужчин
Риск эмбриофетальной токсичности со стороны мужчин в результате терапии терифлуномидом считается низким.
Управление транспортом
Терифлуномид не оказывает или оказывает незначительное влияние на способность управлять автомобилем или пользоваться механизмами. Однако при возникновении нежелательных явлений со стороны нервной системы, например, головокружения, следует воздержаться от управления транспортными средствами и занятий другими потенциально опасными видами деятельности.
Дополнительные указания при приеме Феморикс®
Лечение должно проводиться под наблюдением врача, имеющего опыт лечения пациентов с рассеянным склерозом.
Мониторинг
До начала лечения следует провести следующие исследования:
- Измерение артериального давления
- Активность аланинаминотрансферазы (АЛТ)
- Общий анализ крови, включая лейкоцитарную формулу и определение количества тромбоцитов в крови
Во время лечения терифлуномидом следует регулярно контролировать следующие параметры
- Артериальное давление
- Активность аланинаминотрансферазы (АЛТ)
В случае появления новых симптомов и признаков (например, инфекции) во время лечения необходимо выполнить общий анализ крови, включая лейкоцитарную формулу, и определение количества тромбоцитов в крови.
Процедура ускоренного выведения
Терифлуномид медленно выводится из плазмы: концентрации в плазме достигают значений ниже 0,02 мг/л в среднем за 8 месяцев, хотя из-за индивидуальных отклонений в процессе выведения лекарственных веществ оно может продолжаться до 2-х лет.
Выведение препарата можно ускорить посредством любой из описанных ниже процедур, приводящих к снижению более чем на 98% уровня концентрации терифлуномида в плазме:
- прием колестирамина в дозе 8 г каждые 8 часов в течение 11 дней. При плохой переносимости колестирамина в дозе 8 г 3 раза в день можно уменьшить дозу до 4 г три раза в день;
- прием активированного угля (50 г порошка) каждые 12 часов в течение 11 дней (ежедневный прием не обязателен, если нет необходимости в быстром снижении концентрации терифлуномида в плазме).
Процедура ускоренного выведения может быть использована в любое время после прекращения приема терифлуномида.
Пациенты старшей возрастной группы
Терифлуномид необходимо назначать с осторожностью пациентам в возрасте 65 лет и старше в связи с недостаточным количеством данных об эффективности и безопасности в данной возрастной группе.
Детская популяция
Безопасность и эффективность терифлуномида у детей в возрасте от 10 до 18 лет не установлена. Терифлуномид не назначается детям в возрасте до 10 лет для лечения рассеянного склероза.
Почечная недостаточность
У пациентов с почечной недостаточностью легкой, средней или тяжелой степени, не находящихся на гемодиализе, коррекция дозы не требуется.
Пациенты с почечной недостаточностью тяжелой степени, находящиеся на гемодиализе, не принимали участия в клинических исследованиях. Терифлуномид этой группе пациентов противопоказан.
Печеночная недостаточность
У пациентов с печеночной недостаточностью легкой или средней степени коррекция дозы не требуется.
Терифлуномид противопоказан пациентам с тяжелой печеночной недостаточностью.
У пациентов, принимавших терифлуномид, наблюдалось повышение активности ферментов печени. Эти нежелательные реакции происходили в основном в первые 6 месяцев лечения.
Активность печеночных ферментов необходимо проконтролировать перед началом терапии терифлуномидом, затем каждые две недели в течение первых 6 месяцев лечения и каждые 8 недель впоследствии, или при соответствующих клинических признаках и симптомах, таких как тошнота, рвота, боль в брюшной полости, утомляемость, потеря аппетита или желтуха и/или потемнение мочи. Для АЛТ допустимо повышение, кратное 2-3 верхним границам нормы, при этом мониторинг должен проводиться еженедельно. Терапия терифлуномидом должна быть прекращена при подозрении на поражение печени. Следует рассмотреть необходимость прекращения терапии терифлуномидом при подтвержденном повышении активности печеночных ферментов (более чем в 3 раза от ВГН). Пациенты с заболеваниями печени в анамнезе входят в группу риска ухудшения функции печени на фоне приема терифлуномида. В данной группе пациентов симптомы поражения печени должны тщательно мониторироваться.
Терифлуномид необходимо назначать с осторожностью пациентам, злоупотребляющим алкоголем.
Поскольку терифлунамид в высокой степени связан с белком, и поскольку связывание зависит от уровня альбумина, концентрация несвязанного терифлуномида в плазме может повышаться у пациентов с гипопротеинемией, например, при нефротическом синдроме. Терифлуномид не следует назначать пациентам с выраженной гипопротеинемией.
Артериальное давление
На фоне применения терифлуномида может отмечаться повышение артериального давления. Необходимо проконтролировать артериальное давление перед началом лечения терифлуномидом и периодически впоследствии. В случае повышения артериального давления необходимо проводить соответствующую антигипертензивную терапию до и на фоне лечения терифлуномидом.
Инфекции
Начало лечения терифлуномидом необходимо откладывать у пациентов, имеющих серьезные активные инфекции, до полного выздоровления.
В плацебо-контролируемых исследованиях при приеме терифлуномида повышения частоты серьезных инфекций не отмечено. Однако, с учетом иммуномодулирующего эффекта терифлуномида, в случае развития у пациента серьезной инфекции, необходимо рассмотреть необходимость приостановки лечения препаратом, и перед возобновлением терапии оценить возможные преимущества и риски. В связи с длительным периодом полувыведения препарата необходимо рассмотреть необходимость проведения ускоренной элиминации с помощью колестирамина или активированного угля.
Пациенты, принимающие терифлуномид, должны немедленно сообщать о симптомах инфекции врачу. Пациенты с активными острыми и хроническими инфекциями не должны начинать лечение терифлуномидом до полного излечения.
Безопасность терифлуномида у лиц с латентной туберкулезной инфекцией неизвестна. Скрининг на туберкулез в клинических исследованиях систематически не проводился. Пациентам, имеющим позитивный тест на туберкулез на скрининге, перед началом приема терифлуномида необходимо пройти соответствующее лечение.
Респираторные реакции
В клинических исследованиях терифлуномида случаев интерстициальных заболеваний легких не зафиксировано. Однако, о таких потенциально летальных заболеваниях сообщалось на фоне приема лефлуномида. На фоне терапии интерстициальные заболевания легких могут развиваться остро. Риск повышен у пациентов с такими заболеваниями в анамнезе, выявленными на фоне лечения лефлуномидом.
Легочные симптомы, такие как постоянный кашель и одышка, могут стать причиной прекращения терапии и проведения дальнейшего обследования.
Гематологические эффекты
Наблюдается умеренное уменьшение количества белых клеток крови менее чем на 15% от исходного уровня. В качестве меры предосторожности перед началом терапии терифлуномидом необходимо выполнить общий клинический анализ крови с определением лейкоцитарной формулы и количества тромбоцитов. Па фоне терапии терифлуномидом необходимо выполнять общий клинический анализ крови по показаниям при появлении клинических симптомов и признаков (например, при инфекциях).
У пациентов с существующей анемией, лейкопенией и/или тромбоцитопенией, а также у пациентов с нарушенной функцией костного мозга или имеющих риск супрессии костномозгового кроветворения, риск гематологических заболеваний на фоне терапии терифлуномидом повышен. В случае развития указанных нежелательных реакций необходимо рассмотреть возможность применения процедуры ускоренного выведения для уменьшения концентрации терифлуномида в плазме.
В случаях выраженных гематологических реакций, включая панцитопению, прием терифлуномида и любого другого миелосупрессирующего препарата должен быть прекращен. Необходимо рассмотреть целесообразность проведения процедуры ускоренного выведения.
Кожные реакции
Были зафиксированы случаи тяжелых кожных реакций (включая синдром Стивенса-Джонсона и токсичный эпидермальный некролиз).
У пациентов, получавших лефлуномид, также сообщалось об очень редких случаях лекарственного взаимодействия, проявлявшихся эозинофилией и системными симптомами (DRESS-синдром).
В случае появления язвенного стоматита прием терифлуномида следует прекратить. Если при развитии реакций со стороны кожи и/или слизистых подозреваются серьезные генерализованные кожные реакции (синдром Стивена-Джонсона или токсичный эпидермальный некролиз - синдром Лайелла), прием терифлуномида и любых других препаратов, потенциально вызывающих подобные реакции, необходимо прекратить, а также следует немедленно начать процедуру ускоренного выведения. В таких случаях пациентам не следует вновь назначать терифлуномид.
Периферическая нейропатия
У пациентов, принимавших терифлуномид, были зафиксированы случаи периферической нейропатии. После прекращения приема препарата состояние большинства пациентов улучшалось, у некоторых пациентов периферическая нейропатия регрессировала полностью, а у части пациентов интенсивность симптомов не менялась. Если у пациента, принимавшего терифлуномид, диагностирована периферическая нейропатия, следует рассмотреть возможность прекращения приема терифлуномида и проведение процедуры ускоренного выведения.
Вакцинация
Два клинических исследования показали, что вакцинации инактивированным неоантигеном (первая вакцинация) или сенсибилизирующим антигеном (стимуляция) были безопасными и эффективными во время лечения терифлуномидом.
Применение живых ослабленных вакцин может быть связано с риском инфицирования и поэтому его следует избегать.
Иммуносупрессивная и иммуномодулирующая терапия
Поскольку лефлуномид является исходным соединением для терифлуномида, совместный прием терифлуномида с лефлуномидом не рекомендован.
Совместный прием с ангинеопластическими или иммуносупрессивными препаратами, используемыми для лечения рассеянного склероза, не изучался. Исследования безопасности, в которых терифлуномид вводился одновременно с интерфероном бета или глатирамера ацетатом на протяжении одного года, не выявили проблем с безопасностью, но наблюдалась более высокая частота нежелательных реакций, в сравнении с монотерапией терифлуномидом. Безопасность этой комбинации при длительном приеме для лечения рассеянного склероза не исследовалась.
Переход на или с терифлуномида
На основании клинических данных, относящихся к одновременному приему терифлуномида с интерфероном бета или с глатирамера ацетатом, можно сказать, что нет никакой необходимости в периоде ожидания при начале терапии терифлуномидом после интерферона бета или глатирамера ацетата, или при начале терапии интерфероном бета или глатирамера ацетатом после терифлуномида.
В связи с длительным периодом полувыведения натализумаба одновременная экспозиция и, следовательно, одновременное воздействие на иммунную систему может произойти в случае начала терапии терифлуномидом в течение 2-3-х месяцев после прекращения приема натализумаба. Поэтому следует соблюдать меры предосторожности при переходе с терапии натализумабом на терифлуномид.
С учетом периода полувыведения финголимода необходим 6-недельный интервал без терапии для элиминации из организма циркулирующих веществ. От 1 до 2-х месяцев необходимо для возвращения количества лимфоцитов к норме после прекращения приема финголимода. Это может привести к сочетанному воздействию на иммунную систему. Поэтому следует соблюдать меры предосторожности при переходе с терапии финголимодом на терифлуномид.
При PC медиана t 1/2z была приблизительно 19 дней после повторяемых доз в 14 мг. Если принято решение об остановке лечения терифлуномидом в ходе интервала в 5 полувыведений (приблизительно 3,5 месяца, хотя у некоторых пациентов может быть и дольше), начало другой терапии приведет к одновременной экспозиции с терифлуномидом. Это может привести к аддитивному эффекту на иммунную систему, что требует обязательного соблюдения мер предосторожности.
Передозировка
Симптомы
Информации по передозировке или интоксикации терифлуномидом у человека нет. Терифлуномид в дозе 70 мг ежедневно принимался здоровыми участниками в течение 14 дней. Наблюдаемые нежелательные реакции соответствовали профилю безопасности терифлуномида при приеме пациентами с рассеянным склерозом.
Лечение
В случае существенной передозировки или токсичности для ускоренного выведения рекомендуется колестирамин или активированный уголь. Рекомендованной процедурой является прием колестирамина в дозе 8 г 3 раза в день в течение 11 дней, или, в случае плохой переносимости этой дозы, можно снизить дозу колестирамина до 4 г. Альтернативно можно принимать по 50 г активированного угля каждые 12 часов на протяжении 11 дней.
Как хранить препарат
При температуре не выше 30 °С.
Хранить в недоступном для детей месте.
Срок годности
3 года. Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
По рецептуИнформация по упаковке
По 10 или 14 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной.
По 1, 3 или 5 контурных ячейковых упаковок по 10 таблеток или 2, 6 или 10 контурных ячейковых упаковок по 14 табле
Информация для врачей о препарате Феморикс®
Фармакологическая группа
Селективный иммунодепрессантФармакодинамика
Терифлуномид - иммуномодулирующий лекарственный препарат с противовоспалительными свойствами, селективно и обратимо ингибирующий митохондриальный фермент дигидрооротатдигидрогеназу (ДГО-ДГ), который необходим для синтеза пиримидина de novo. Таким образом, терифлуномид блокирует пролиферацию стимулированных лимфоцитов, для которых необходим синтез пиримидина de novo. Точный механизм действия терифлуномида при рассеянном склерозе до конца не изучен, но может быть обусловлен уменьшением количества циркулирующих лимфоцитов.
Фармакодинамические эффекты
Иммунная система
Влияние на количество иммунных клеток в крови: в ходе плацебо-контролируемых исследований прием терифлуномида в дозе 14 мг один раз в день в среднем приводил к незначительному снижению количества лимфоцитов, менее чем на 0,3 х 109/л, что было отмечено в течение первых 3-х месяцев лечения. Достигнутые уровни сохранялись до окончания лечения.
Влияние на интервал QТ
В ходе плацебо-контролируемого исследования, проведенного с участием здоровых добровольцев, терифлуномид при средних равновесных концентрациях не продемонстрировал потенциала к удлинению интервала QTcF по сравнению с плацебо: самое большое среднее различие между терифлуномидом и плацебо составило 3,45 мс с верхней границей 90%-го доверительного интервала, равной 6,45 мс.
Влияние на функцию почечных канальцев
В ходе плацебо-контролируемых исследований было отмечено более выраженное снижение концентрации мочевой кислоты в сыворотке в диапазоне от 20 до 30% у пациентов, принимавших терифлуномид, по сравнению с плацебо. Среднее снижение содержания фосфора в сыворотке составило около 10% в группе терифлуномида по сравнению с плацебо. Предполагается, что такие эффекты связаны с увеличением канальцевой экскреции и не связаны с изменениями в клубочковых функциях.
Клиническая эффективность и безопасность
Эффективность терифлуномида была продемонстрирована в ходе исследований EFC6049/TEMSO и TOWER, которые были посвящены оценке ежедневного приема терифлуномида в дозе 7 мг и 14 мг у пациентов с рецидивирующим рассеянным склерозом (РРС).
В целом 1088 пациентов с РРС были рандомизированы в исследование TEMSO для приема 7 мг (n=366) или 14 мг (n=359) терифлуномида или плацебо (n=363) в течение 108 недель. Всем пациентам был поставлен диагноз (на основании критериев МакДональда (2001)) рассеянный склероз, рецидивирующее течение, с или без прогрессирования; у пациентов был отмечен, как минимум, 1 рецидив в течение года, предшествующего исследованию, или как минимум, 2 рецидива за 2 года, предшествующих исследованию. При включении в исследование средний балл по расширенной шкале инвалидизации EDSS (Expanded Disability Status Scale) составлял ? 5,5. Средний возраст популяции исследования - 37,9 лет. Большинство пациентов имели ремиттирующую форму рассеянного склероза (91,5%), также были представлены подгруппы пациентов с вторичным прогрессирующим (4,7 %) или прогрессирующе-рецидивирующим рассеянным склерозом (3,9%). Среднее количество обострений в течение года перед включением в исследование 1,4, при этом исходно у 36,2 % пациентов были очаги, накапливающие контрастное вещество гадолиний. Средний исходный балл EDSS - 2,50: исходно у 249 пациентов (22,9%) балл EDSS составлял более 3,5. Средняя продолжительность заболевания с момента появления первых симптомов - 8,7 лет. Большинство пациентов (73%) не принимало препаратов, изменяющих течение рассеянного склероза (ПИТРС) в течение 2-х лет перед включением в исследование. Результаты исследования представлены в таблице 1.
В целом 1169 пациентов с РРС были включены в исследование TOWER для приема 7 мг (n=408) или 14 мг (n=372) терифлуномида или плацебо (n=389). Длительность лечения составила 48 недель после включения последнего пациента. Все пациенты имели установленный диагноз рассеянный склероз (основанный на критерии МакДональда (2001)), рецидивирующее течение, с или без прогрессии, и перенесли как минимум один эпизод рецидива за год перед исследованием или как минимум 2 рецидива за два года перед исследованием. При включении пациенты имели оценку по расширенной шкале инвалидизации EDSS (Expanded Disability Status Scale) ? 5,5.
Средний возраст исследуемых пациентов был 37,9 лет. Большинство пациентов имели рецидивирующий ремитирующий рассеянный склероз (97,5%), но были подгруппы пациентов с вторичным прогрессирующим (0.8%) или прогрессирующе-рецидивирующим рассеянным склерозом (1,7%). Среднее количество рецидивов в течение года перед включением в исследование - 1,4. Средний исходный балл EDSS - 2,50. Средняя продолжительность заболевания с момента появления первых симптомов - 8 лет.
Большинство пациентов (67,2%) не принимало препаратов, изменяющих течение заболевания, в течение 2-х лет перед включением в исследование. Результаты исследования представлены в таблице 1.
Таблица 1. Главные результаты (для указанной дозы, популяция ITT)
| Исследование TEMSO | Исследование TOWER | ||||
| Терифлуномид 14 мг | Плацебо | Терифлуномид 14 мг | Плацебо | ||
| N | 358 | 363 | 370 | 388 | |
| Клинические исходы | |||||
| Количество рецидивов за год | 0,37 | 0,54 | 0,32 | 0,50 | |
| Отношение шансов (ДИ95 %) | -0,17(-0,26,-0,08)*** | -0,18(-0,27, -0,09)*** | |||
| Без рецидивов неделя 108 | 56,5% | 45,6% | 57,1% | 46,8% | |
| Отношение шансов (ДИ95 %) | 0,72 (0,58, 0,89)** | 0,63 (0,50, 0,79)*** | |||
| Подтвержденная прогрессия инвалидности за 3 месяца недели 108 | 20,2% | 27,3% | 15,8% | 19,7% | |
| Отношение шансов (ДИ95 %) | 0,70 (0.51,0,97)* | 0,68 (0,47, 1,00)* | |||
| Подтвержденная прогрессия инвалидности за 6 месяцев недели 108 | 13,8% | 18,7% | 11,7% | 11,9% | |
| Отношение шансов (ДИ95 %) | 0,75 (0,50, 1,11) | 0,84 (0,53 | , 1,33) | ||
| Конечная точка МРТ | |||||
| Изменение BOD недели 1081 | 0,72 | 2,21 | |||
| Изменения относительно плацебо | 67%*** | ||||
| Среднее количество очагов, накапливающих Гд на сканограмме к неделе 108 | 0,38 | 1,18 | |||
| Изменения относительно плацебо (ДИ95 %) | -0,8 (-1,20, -0,39)**** | Не измерялось | |||
| Количество унифицированных активных очагов на сканограмму | 0,75 | 2,46 | |||
| Изменения относительно плацебо (ДИ95 %) | 69% (59%, 77%)**** | ||||
1.BOD: общий объем очагов в мл (Т2 и гипоинтенсивных Т1)
Эффективность у пациентов с высокой активностью заболевания:
Значимый эффект терапии терифлуномидом отмечен в отношении обострений и подтвержденной за 3 месяца прогрессии нетрудоспособности в подгруппе пациентов с высокой активностью заболевания в исследовании TEMSO (n=127). В соответствии с дизайном исследования высокая активность заболевания была определена как 2 или более рецидива в течение года и наличие одного или более очагов, накапливающих гадолиний, на МРТ головного мозга. Подобный анализ подгрупп в исследовании TEMSO не проводился, поскольку не было получено данных МРТ. Отсутствуют данные о пациентах, не отвечающих на полный и достаточный курс лечения (в среднем 1 год терапии) бета- интерфероном, и имеющих как минимум 1 рецидив в течение предыдущего года на фоне терапии, и как минимум 9 Т2-гиперинтенсивных очагов на МРТ черепных нервов или как минимум 1 очаг, накапливающий гадолиний, или о пациентах, у которых скорость возникновения обострений не изменилась или уменьшилась в течение предыдущего года при сравнении с предыдущими 2 годами.
TOPIC - это двойное слепое, плацебо контролируемое исследование, в ходе которого оценивали назначаемые один раз в сутки дозы терифлуномида 7 мг и 14 мг в течение 108 недель пациентам с первым клиническим демиелинизирующим эпизодом (средний возраст 32,1 лет). Основным критерием оценки было время до второго клинического эпизода (рецидива). В общей сложности 618 пациентов были рандомизированы в группы, получающие 7 мг (n=205) или 14 мг (п=216) терифлуномида или плацебо (n=197). Риск второго клинического обострения на протяжении 2 лет составлял 35,9% в группе плацебо и 24,0% в группе лечения терифлуномидом в дозе 14 мг (соотношение рисков: 0,57, 95% доверительный интервал: 0,38 - 0,87, р=0,0087). Результаты, полученные в ходе исследования TOPIC, подтвердили эффективность терифлуномида при ремиттирующем рассеянном склерозе (в том числе при раннем ремиттирующем рассеянном склерозе с первым клиническим демиелинизирующим эпизодом и MPT-очагах различной давности и локализации). Эффективность терифлуномида сравнивали с эффективностью подкожной формы интерферона бега-1а (в рекомендованной дозе, составляющей 44 мкг, три раза в неделю) в рамках исследования с участием 324 пациентов (TENERE). Минимальная продолжительность лечения составила 48 недель, максимальная - 114 недель. Риск неэффективности терапии (подтвержденный рецидив или полное прекращение лечения, независимо от того, что произошло в первую очередь) стал первичной конечной точкой. Количество пациентов, окончательно прекративших лечение, в группе терифлуномида 14 мг - 22 из 111 (19,8%). Причинами были нежелательные явления (10,8%), недостаточная эффективность (3,6%), другие причины (4,5%) и потеря дальнейшего наблюдения (0,9%). Количество пациентов, окончательно прекративших лечение, в группе интерферона бета-1а - 30 из 104 (28,8%). Причинами были нежелательные явления (21,2%), недостаточная эффективность (1,9%), другие причины (4,8%) и невыполнение условий протокола (1%). Терифлуномид в дозе 14 мг/день не превосходил интерферон бета-1а по влиянию на первичную конечную точку. Процент пациентов с подтвержденной неудачей терапии к 96-ой неделе по методу Каплана-Мейера составил 41,1% на фоне терифлуномида 14 мг по сравнению с 44,4% на фоне интерферона бета-1а (р=0,5953).
Клинические данные об эффективности и безопасности применения терифлуномида у детей в возрасте от 0 до 18 лет отсутствуют.
Фармакокинетика
Всасывание
Средний период достижения максимальных концентраций в плазме составляет от 1 до 4 часов после многократного перорального введения терифлуномида при высокой биодоступности (приблизительно 100%).
Пища не оказывает клинически значимого эффекта на фармакокинетику терифлуномида. На основании средних прогнозированных фармакокинетических параметров, рассчитанных на основании анализа популяционной фармакокинетики (РорРК) с использованием данных о здоровых добровольцах и пациентах с рассеянным склерозом, отмечается медленное приближение к равновесной концентрации (т.е. приблизительно 100 дней (3,5 месяца) до достижения 95% равновесных концентраций), а предполагаемая норма накопления AUC превышает исходную приблизительно в 34 раза.
Распределение
Терифлуномид активно связывается с белками плазмы (>99%), вероятно, с альбумином и, по большей части, распределяется в плазме.
Биотрансформация
Терифлуномид умеренно метаболизируется и является единственным компонентом, определяемым в плазме.
Терифлуномид выделяется в желудочно-кишечный тракт, в основном с желчью, в неизмененном виде. Период полувыведения после многократного приема составляет 19 дней. После однократного внутривенного введения общий клиренс терифлуномида из организма составляет 30,5 мл/ч.
Выведение терифлуномида из кровотока можно ускорить с помощью назначения колестирамина или активированного угля, вероятно, за счет прерывания процесса реабсорбции в кишечнике. Концентрации терифлуномида, измеренные во время 11-дневной процедуры, направленной на ускорение выведения терифлуномида с помощью приема колестирамина в дозе 4 г 3 раза в день; колестирамина 8 г 3 раза в день или 50 г активированного угля два раза в день после прекращения лечения терифлуномидом, указывают на то, что эти схемы привели к снижению концентрации терифлуномида в плазме более чем на 98%. При этом действие колестирамина было более быстрым, чем действие активированного угля. Выбор между тремя процедурами ускоренного выведения должен зависеть от переносимости у пациента. При плохой переносимости колестирамина в дозе 8 г три раза в день можно использовать дозу 4 г три раза в день. В качестве альтернативы можно также использовать активированный уголь (препарат необязательно принимать 11 дней подряд, если только нет необходимости в быстром снижении концентрации терифлуномида в плазме).
Взаимодействие с другими веществами
Фармакокинетические взаимодействия с другими веществами при приеме терифлуномида
Первичный путь биотрансформации терифлуномида - гидролиз; второстепенный путь - окисление.
Одновременное длительное применение (600 мг один раз в день в течение 22 дней) рифампицина (индуктора изофермента CYP2B6, 2С8, 2С9, 2С19, 3А), а также индуктора белков-переносчиков, Р-гликопротеина [P-gp] и белка резистентности к раку молочной железы [BCRP], и терифлуномида (разовая доза, составляющая 70 мг) привели к снижению воздействия терифлуномида приблизительно на 40%. Рифампицин и другие известные индукторы CYP и белков переносчиков, такие как карбамазепин, фенобарбитал, фенитоин и зверобой продырявленный следует назначать с осторожностью на фоне терапии терифлуномидом.
Колестирамин или активированный уголь
Не рекомендован одновременный прием терифлуномида и колестирамина или активированного угля, поскольку это ведет к быстрому и существенному уменьшению концентрации терифлуномида в плазме, за исключением случаев, когда необходимо ускоренное выведение. Механизмом ускоренного выведения, вероятно, является прерывание печеночнокишечных циклов и/или желудочно-кишечный диализ терифлуномида.
Фармакокинетические взаимодействия терифлуномида с другими веществами
Воздействие терифлуномида па субстрат CYP2C8: репаглинид
Было отмечено увеличение среднего значения Сmах и AUC для репаглинида (1,7- и 2.4-кратное, соответственно) после приема многократных доз терифлуномида, что позволяет предположить, что терифлуномид действует как ингибитор изофермента CYP2C8 in vivo.
Поэтому на фоне назначения терифлуномида лекарственные средства, метаболизируемые изоферментом CYP2C8, такие как репаглинид, паклитаксел, пиоглитазон или росиглитазон, следует применять с осторожностью.
Воздействие терифлуномида на оральные контрацептивы: 0,03 мг этинилэстрадиола и 0,15 мг левоноргестрела
После приема многократных доз терифлуномида было отмечено увеличение среднего значения Сmах и AUC0-24 для этинилэстрадиола (1,58- 1,54-кратное, соответственно), и Сmах и AUC0-24 левоноргестрела (1,33- и 1,41-кратное, соответственно). При том, что такое взаимодействие терифлуномида не должно оказывать неблагоприятного воздействия на эффективность оральных контрацептивов, следует учитывать тип и дозу оральных контрацептивов, используемых в сочетании с терифлуномидом.
Взаимодействие терифлуномида на субстрат изофермента CYP1A2: кофеин
Повторные дозы терифлуномида снизили среднее значение Сmах и AUC для кофеина (субстрат изофермента CYP1A2) на 18% и 55% соответственно, что позволяет предположить, что терифлуномид в меньшей степени индуцирует изофермент CYP1A2 in vivo. Поэтому, лекарственные препараты, метаболизирующиеся под действием изофермента CYP1A2 (такие, как дулоксетин, алосетрон, теофиллин и тизанидин) во время лечения с применением терифлуномида следует использовать с осторожностью, поскольку это может привести к снижению эффективности этих продуктов.
Воздействие терифлуномида на варфарин
Повторные дозы терифлуномида не оказали влияния на фармакокинетику S-варфарина, что показывает, что терифлуномид не является ингибитором или индуктором изофермента CYP2C9. Тем не менее, было отмечено уменьшение на 25% пикового международного нормализованного отношения (МНО) при одновременном введении терифлуномида и варфарина, по сравнению с введением только варфарина. Поэтому при одновременном введении варфарина и терифлуномида рекомендуется тщательный последующий и текущий контроль МНО.
Влияние терифлуномида на субстраты переносчиков органических анионов 3 (ПОА3)
Наблюдается увеличение концентрации Сmах и AUC (1,43- и 1,54-кратное, соответственно) цефаклора после повторных доз терифлуномида, что говорит о том, что терифлуномид является ингибитором ПОАЗ in vivo. Поэтому следует проявлять осторожность, если терифлуномид назначается совместно с субстратами ПОАЗ, такими как цефаклор, бензилпенициллин, ципрофлоксацин, индометацин, кетопрофен, фуросемид, циметидин, метотрексат и зидовудин.
Влияние терифлуномида на BCRP и/или органические анионы, транспортирующие субстраты полипептидов В1 и В3 (OATP1В1/В3)
Наблюдалось увеличение значения Сmах и AUC (2,64 и 2,51-кратное, соответственно) розувастатина после введения повторных доз терифлуномида. Однако, не наблюдалось явного влияния данного увеличения экспозиции розувастатина в плазме на активность HMG-CoA редуктазы. Для розувастатина уменьшение дозы на 50% рекомендуется для совместного приема с терифлуномидом. Другие субстанции BCRP (например, метотрексат, топотекан, сульфазалин, даунорубицин, доксорубицин) и семейство ОАТР, особенно ингибиторы HMG-CoA редуктазы (например, симвастатин, аторвастатин, правастатин, метотрексат, натеглинид, репаглинид, рифампицин) одновременно с терифлуномидом следует назначать с осторожностью. У пациентов необходимо проводить тщательный мониторинг на признаки и симптомы избыточного воздействия лекарственных средств и при необходимости уменьшать дозу.

Секреты долголетия: уроки из синих зон Земли

Влияние микропластика на здоровье: что говорят эксперты

Новый подход к менопаузе: заморозка ткани яичника может изменить все

Омега-3 vs. витамин D: что выбрать для здоровья иммунной системы?

Сможем ли мы добавить больше активной жизни к нашим годам?

Новое исследование: как фантазии помогают укрепить память
 Действие физических нагрузок на организм, на сердце и сосуды
Действие физических нагрузок на организм, на сердце и сосуды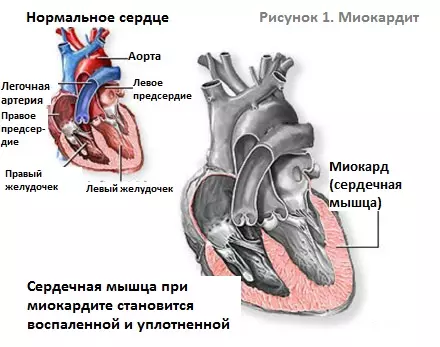 Острый и инфекционный миокардит
Острый и инфекционный миокардит Внезапная коронарная смерть
Внезапная коронарная смерть Митральная недостаточность (регургитация митрального клапана)
Митральная недостаточность (регургитация митрального клапана)

